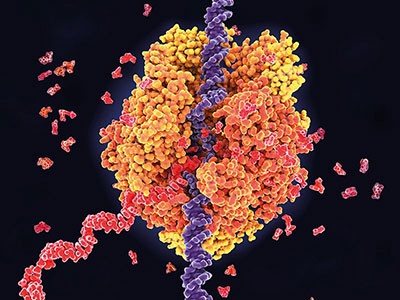
Er wordt aangeprezen dat hulpmiddelen voor het bewerken van messenger-RNA (illustratie van de kunstenaar) veiliger en flexibeler zijn dan het CRISPR-Cas9-systeem, dat het genoom zelf verandert.Krediet: Christoph Burgstedt/Science Picture Library
RNA-editing wint aan kracht. Na decennia van foundation onderzoek Om te onderzoeken hoe dit complexe molecuul kan worden gemanipuleerd, zijn ten minste drie therapieën gebaseerd op RNA-bewerking klinische onderzoeken gestart of hebben daarvoor goedkeuring gekregen. Zij zijn de eersten die deze mijlpaal bereiken.
Voorstanders van RNA-bewerking hebben lang betoogd dat het een veiliger en flexibeler alternatief zou kunnen zijn genoombewerkingstechnieken zoals CRISPRmaar het levert aanzienlijke technische problemen op.
De lancering van proeven op mensen is een teken van de groeiende volwassenheid en acceptatie van het vakgebied, zeggen wetenschappers. “Er is een veel beter begrip van RNA-technologie, en dat is gedeeltelijk verbeterd door het RNA-vaccin en de COVID-pandemie”, zegt Andrew Lever, een bioloog aan de Universiteit van Cambridge, VK. “RNA wordt nu gezien als een heel belangrijk therapeutisch molecuul.”
Tijdelijke baan
RNA speelt een cruciale rol bij de eiwitsynthese: de genetische informatie die in DNA wordt gecodeerd, wordt getranscribeerd in messenger-RNA (mRNA) voordat deze in eiwitten wordt vertaald. RNA-moleculen zijn samengesteld uit bouwstenen die nucleotiden worden genoemd en die elk een van de vier basen of letters bevatten.
RNA-therapieën uitgelegd
RNA-bewerkingstechnieken zijn bedoeld om schadelijke mutaties te compenseren door de sequentie van RNA te veranderen, waardoor normale eiwitten kunnen worden gesynthetiseerd. RNA-bewerking kan ook de productie van nuttige eiwitten verhogen.
In tegenstelling tot CRISPR-genoombewerking verandert RNA-bewerking geen genen. Het introduceert ook geen permanente veranderingen, omdat RNA-moleculen van voorbijgaande aard zijn. Dit betekent dat de duur van het therapeutische impact korter zou kunnen zijn.
Maar die vergankelijkheid kan veiligheidsvoordelen bieden. Eén risico van CRISPR-therapieën is effecten buiten het doelof onbedoelde veranderingen buiten het beoogde genomische gebied, merkt Joshua Rosenthal op, een neurobioloog bij het Marine Organic Laboratory in Woods Gap, Massachusetts. “Een off-target impact in DNA is potentieel behoorlijk gevaarlijk. Bij RNA is dat minder het geval, omdat het zal omslaan.”
Eén letter tegelijk
Eén veel voorkomende RNA-bewerkingsaanpak, single-base enhancing, maakt gebruik van een enzym dat al in cellen wordt aangetroffen: adenosinedeaminase dat inwerkt op RNA (ADAR). Dit enzym verwisselt een base genaamd adenine in de RNA-sequentie voor een base genaamd inosine.
Wave Life Sciences in Cambridge, Massachusetts, onderzoekt single-base enhancing om een genetische aandoening te behandelen die alfa-1 antitrypsinedeficiëntie (AATD) wordt genoemd en die de longen en de lever kan beschadigen. De ziekte vermindert de productie van AAT, een eiwit dat in de levercellen wordt gemaakt en dat de longen beschermt tegen schade veroorzaakt door het inademen van vervuilde lucht of andere irriterende stoffen.
Het product van Wave is een korte keten van nucleotiden die van nature voorkomende ADAR-enzymen aansturen om een specifieke letter in elk mRNA-molecuul te veranderen om de mutatie te corrigeren die de AAT-productie beïnvloedt. “Door de endogene machinerie van de cel te gebruiken om die ene base te bewerken, maak je nu een normaal eiwit. En we hebben aangetoond dat het normale eiwit op hoge niveaus tot expressie kan worden gebracht”, zegt Paul Bolno, president en CEO van Wave.
Bij muizen bewerkte het medicijn ongeveer 50% van het doel-mRNA in de levercellen, wat voldoende is om therapeutische effecten te veroorzaken, zegt Bolno.
De klinische proef van het medicijn door het bedrijf begon afgelopen december in het Verenigd Koninkrijk en Australië en zal de veiligheid en andere kenmerken van het medicijn evalueren.
Hele alinea’s bewerken
Een andere benadering, RNA exon enhancing genaamd, verandert duizenden genetische letters in een RNA-molecuul tegelijk, in plaats van slechts één letter te veranderen. Exon-bewerking is vergelijkbaar met het bewerken van een hele alinea in plaats van het corrigeren van één typefout, zegt Lever. Deze technologie is vooral van belang bij aandoeningen die veroorzaakt worden door meerdere mutaties in het genoom van een persoon; Dergelijke reeksen mutaties zijn moeilijk aan te pakken met veranderingen op één base, voegt hij eraan toe.
De techniek richt zich op pre-mRNA, dat wordt getranscribeerd uit DNA en vervolgens wordt verwerkt om mRNA te maken. Pre-mRNA omvat zowel exons (delen van het RNA-transcript die instructies bevatten voor het maken van eiwitten) als introns, die dergelijke instructies niet bevatten. Through een mechanisme dat RNA-splitsing wordt genoemd, worden de introns uit het pre-mRNA geknipt en worden de exons aan elkaar gehecht om het uiteindelijke mRNA te vormen, dat in eiwit wordt vertaald.
Verzamel meer gegevens uit Afrika om gentherapie te verbeteren
Bedrijven zoals Ascidian Therapeutics in Boston, Massachusetts, maken gebruik van het RNA-splitsingsproces om mutatiebevattende exonen te verwijderen en te vervangen door gezonde exonen. Vorige maand kreeg Ascidian goedkeuring van de Amerikaanse Meals and Drug Administration voor een klinische proef met een exon-editor voor de behandeling van de ziekte van Stargardt, die verlies van het gezichtsvermogen veroorzaakt. Mensen met de ziekte hebben verschillende mutaties in één enkel gen, wat leidt tot de productie van een defect eiwit dat normaal gesproken het netvlies beschermt.
De therapie van Ascidian is afhankelijk van een gemanipuleerd DNA-segment dat in cellen wordt afgeleverd en normale RNA-exons produceert. Deze vervangen de gemuteerde eiwitten tijdens het splitsingsproces, wat resulteert in functionele eiwitten. Het DNA produceert ook RNA-sequenties die het bewerken van exonen vergemakkelijken.
“Met één molecuul kan (de therapie) 22 exonen tegelijk vervangen”, zegt bioloog Robert Bell, hoofd onderzoek bij Ascidian.
Kanker vernietigend RNA
Het potentieel van op RNA gebaseerde therapieën beperkt zich niet tot genetische ziekten. Rznomics, een biofarmaceutisch bedrijf in Seongnam, Zuid-Korea, check een RNA-editor om hepatocellulair carcinoom, de meest voorkomende vorm van leverkanker, te behandelen. In september 2022 startte het bedrijf een klinische proef in Zuid-Korea, die het internationaal wil uitbreiden.
De aanpak van Rznomics omvat het splitsen van mRNA, maar in tegenstelling tot de methode van Ascidian wordt er geen gebruik gemaakt van de eigen splitsingsmachinerie van de cel. In plaats daarvan koos het bedrijf voor een natuurlijk voorkomend ribozym, een RNA-molecuul dat splitsing in doelgebieden van mRNA kan veroorzaken. Onderzoekers hebben de ribozymen ontwikkeld om mRNA’s in tumorcellen open te snijden en een dodelijke lading in te brengen: een RNA-sequentie die wordt vertaald in een eiwit dat een toxine genereert dat celdood induceert. Wanneer omliggende kankercellen in touch komen met deze cellen, verspreidt het toxine zich, waardoor ook hun dood wordt bevorderd. Dit therapeutische molecuul vervangt een RNA-sequentie die geassocieerd is met tumorgroei.
Het gebruik van de splicing-aanpak tegen meer dan één ziekte is erg opwindend, zegt Lever, die ook hoofdarts is van Spliceor in Cambridge, VK, een bedrijf dat werkt aan RNA-splicing-therapieën. “Het opent een geheel nieuw scala aan behandelingsmogelijkheden voor dingen die anders niet behandeld kunnen worden.”