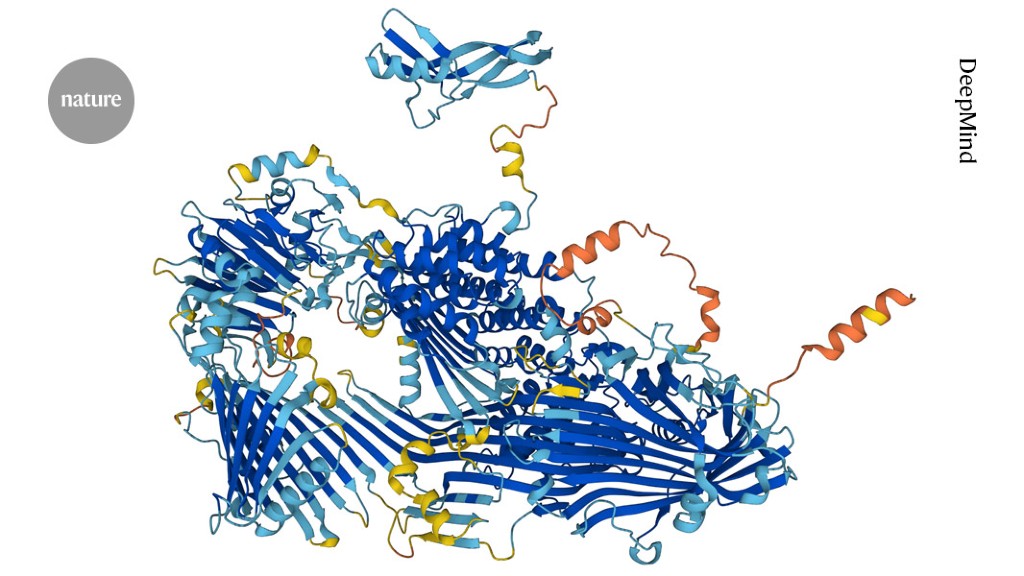
Door AlphaFold voorspelde eiwitstructuren hebben geholpen bij het identificeren van kandidaat-medicijnverbindingen.Krediet: DeepMind
Onderzoekers hebben de eiwitstructuur-voorspellingstool AlphaFold gebruikt om dit te identificeren1 honderdduizenden potentiële nieuwe psychedelische moleculen – die zouden kunnen helpen nieuwe soorten antidepressiva te ontwikkelen. Uit het onderzoek blijkt voor het eerst dat AlphaFold-voorspellingen – die met één druk op de knop beschikbaar zijn – web zo nuttig kunnen zijn voor de ontdekking van geneesmiddelen als experimenteel afgeleide eiwitstructuren, waarvan het bepalen maanden of zelfs jaren kan duren.
AlphaFold wordt aangeprezen als het volgende grote ding op het gebied van de ontdekking van geneesmiddelen – maar is dat ook zo?
De ontwikkeling is een impuls voor AlphaFold, de device voor kunstmatige intelligentie (AI), ontwikkeld door DeepMind in Londen, die een game-changer is geweest in de biologie. De openbare AlphaFold-database bevat structuurvoorspellingen voor bijna elk bekend eiwit. Eiwitstructuren van moleculen die betrokken zijn bij ziekten worden in de farmaceutische industrie gebruikt om veelbelovende medicijnen te identificeren en te verbeteren. Maar sommige wetenschappers begonnen te twijfelen of de voorspellingen van AlphaFold de gouden standaard zouden kunnen zijn voor experimentele modellen in de jacht op nieuwe medicijnen.
“AlphaFold is een absolute revolutie. Als we een goede structuur hebben, zouden we die moeten kunnen gebruiken voor het ontwerpen van medicijnen”, zegt Jens Carlsson, een computationeel chemicus aan de Universiteit van Uppsala in Zweden.
AlphaFold-scepsis
Pogingen om AlphaFold toe te passen bij het vinden van nieuwe medicijnen stuitten op aanzienlijke scepsis, zegt Brian Shoichet, een farmaceutisch chemicus aan de Universiteit van Californië, San Francisco. “Er is veel hype. Telkens wanneer iemand zegt dat ‘dit of dat een revolutie teweeg zal brengen in de ontdekking van geneesmiddelen’, is er enige scepsis nodig.”
Shoichet telt meer dan tien onderzoeken waaruit blijkt dat de voorspellingen van AlphaFold minder bruikbaar zijn dan eiwitstructuren die zijn verkregen met experimentele methoden, zoals röntgenkristallografie, wanneer ze worden gebruikt om potentiële geneesmiddelen te identificeren in een modelleringsmethode die eiwit-ligand-docking wordt genoemd.
Wat is de toekomst voor AlphaFold en de AI-eiwitvouwrevolutie?
Deze aanpak – gebruikelijk in de vroege stadia van de ontdekking van geneesmiddelen – omvat het modelleren van de manier waarop honderden miljoenen of miljarden chemicaliën interageren met belangrijke regio’s van een doeleiwit, in de hoop verbindingen te identificeren die de activiteit van het eiwit veranderen. Uit eerder onderzoek is gebleken dat wanneer door AlphaFold voorspelde structuren worden gebruikt, de modellen slecht zijn in het uitkiezen van geneesmiddelen waarvan al bekend is dat ze aan een bepaald eiwit binden.
Onderzoekers onder leiding van Shoichet en Bryan Roth, een structuurbioloog aan de Universiteit van North Carolina in Chapel Hill, kwamen tot een soortgelijke conclusie toen ze AlphaFold-structuren van twee eiwitten die betrokken zijn bij neuropsychiatrische aandoeningen vergeleken met bekende medicijnen. De onderzoekers vroegen zich af of kleine verschillen met experimentele structuren ervoor zouden kunnen zorgen dat de voorspelde structuren bepaalde verbindingen missen die aan eiwitten binden – maar ze ook in staat zouden stellen om verschillende verbindingen te identificeren die niet minder veelbelovend waren.
Om dit idee te testen gebruikte het group experimentele structuren van de twee eiwitten om honderden miljoenen potentiële medicijnen virtueel te screenen. Eén eiwit, een receptor die de neurotransmitter serotonine waarneemt, werd eerder bepaald met behulp van cryo-elektronenmicroscopie. De structuur van het andere eiwit, de σ-2 receptor, in kaart gebracht met behulp van röntgenkristallografie.
Verschillen in medicijnen
Ze lieten hetzelfde scherm zien met modellen van de eiwitten die uit de AlphaFold-database waren geplukt. Vervolgens synthetiseerden ze honderden van de meest veelbelovende verbindingen die werden geïdentificeerd met de voorspelde en experimentele structuren en maten hun activiteit in het laboratorium.
‘Het zal alles veranderen’: de AI van DeepMind maakt een gigantische sprong in het oplossen van eiwitstructuren
De screens met voorspelde en experimentele structuren leverden totaal verschillende kandidaat-geneesmiddelen op. “Er waren geen twee moleculen die hetzelfde waren”, zegt Shoichet. “Ze leken niet eens op elkaar.”
Maar tot verbazing van het group waren de ‘hit charges’ (het aandeel van gemarkeerde verbindingen die daadwerkelijk de eiwitactiviteit op een betekenisvolle manier veranderden) vrijwel identiek voor de twee groepen. En AlphaFold-structuren identificeerden de medicijnen die de serotoninereceptor het krachtigst activeerden. De psychedelische drug LSD werkt gedeeltelijk by way of deze route, en veel onderzoekers zijn op zoek naar niet-hallucinogene verbindingen die hetzelfde doen, als potentiële antidepressiva. “Het is een werkelijk nieuw resultaat”, zegt Shoichet.
Voorspellende kracht
In ongepubliceerd werk heeft het group van Carlsson ontdekt dat AlphaFold-structuren goed zijn in het identificeren van medicijnen voor een gewilde klasse van doelwitten, genaamd G-eiwit-gekoppelde receptoren, waarvoor hun trefpercentage ongeveer 60% bedraagt.
Vertrouwen hebben in voorspelde eiwitstructuren zou een grote verandering kunnen betekenen voor de ontdekking van medicijnen, zegt Carlsson. Het experimenteel bepalen van structuren is niet triviaal, en veel potentiële doelwitten zullen wellicht niet toegeven aan de bestaande experimentele instrumenten. “Het zou erg handig zijn als we op de knop konden drukken en een structuur konden krijgen die we kunnen gebruiken voor de ontdekking van liganden”, zegt hij.

Isomorphic Labs, een spin-offbedrijf van Google’s DeepMind in Londen, voert zijn inspanningen op het gebied van de ontdekking van geneesmiddelen op met behulp van AlphaFold.Krediet: Igor Golovniov/SOPA Photos/LightRocket by way of Getty
De twee eiwitten die het group van Shoichet en Roth heeft uitgekozen, zijn goede kandidaten om op AlphaFold te vertrouwen, zegt Sriram Subramaniam, een structuurbioloog aan de Universiteit van British Columbia in Vancouver, Canada. Experimentele modellen van verwante eiwitten – inclusief gedetailleerde kaarten van de regio’s waar medicijnen zich eraan binden – zijn direct beschikbaar. “Als je de stapel stapelt, is AlphaFold een paradigmaverschuiving. Het verandert de manier waarop we dingen doen”, voegt hij eraan toe.
“Dit is geen wondermiddel”, zegt Karen Akinsanya, president van onderzoek en ontwikkeling voor therapieën bij Schrödinger, een medicijnsoftwarebedrijf gevestigd in New York Metropolis dat AlphaFold gebruikt. Voorspelde structuren zijn nuttig voor sommige medicijndoelen, maar niet voor andere, en het is niet altijd duidelijk welke van toepassing is. In ongeveer 10% van de gevallen verschillen de voorspellingen die AlphaFold zeer nauwkeurig acht substantieel van de experimentele structuur, zo blijkt uit een onderzoek3 gevonden.
En zelfs als voorspelde structuren kunnen helpen om aanknopingspunten te identificeren, zijn er vaak meer gedetailleerde experimentele modellen nodig om de eigenschappen van een bepaald kandidaat-medicijn te optimaliseren, voegt Akinsanya toe.
Grote weddenschap
Shoichet is het ermee eens dat AlphaFold-voorspellingen niet universeel bruikbaar zijn. “Er waren veel modellen die we niet eens probeerden, omdat we dachten dat ze zo slecht waren”, zegt hij. Maar hij schat dat een AlphaFold-structuur in ongeveer een derde van de gevallen een mission een vliegende begin kan geven. “Vergeleken met het daadwerkelijk opzetten van een nieuwe structuur, zou je het mission een paar jaar vooruit kunnen helpen en dat is enorm”, zegt hij.
Dat is het doel van Isomorphic Labs, DeepMind’s spin-off voor het ontdekken van medicijnen in Londen. Op 7 januari kondigde het bedrijf offers aan ter waarde van minimaal 82,5 miljoen greenback – en tot 2,9 miljard greenback als de zakelijke doelstellingen worden gehaald – om namens farmaceutische giganten Novartis en Eli Lilly op jacht te gaan naar medicijnen met behulp van machine learning-tools zoals AlphaFold.
Het bedrijf zegt dat het werk zal worden ondersteund door een nieuwe versie van AlphaFold die de structuren van eiwitten kan voorspellen wanneer ze gebonden zijn aan medicijnen en andere op elkaar inwerkende moleculen. DeepMind heeft nog niet gezegd wanneer – en of – de replace beschikbaar zal worden gesteld aan onderzoekers, zoals eerdere versies van AlphaFold dat wel zijn geweest. Een concurrerende device genaamd RoseTTAFold All-Atom2 zal binnenkort beschikbaar worden gesteld door de ontwikkelaars.
Dergelijke hulpmiddelen zullen experimenten niet volledig vervangen, zeggen wetenschappers, maar hun potentieel om nieuwe medicijnen te helpen vinden magazine niet worden onderschat. “Er zijn veel mensen die willen dat AlphaFold alles doet, en veel structuurbiologen willen redenen vinden om te zeggen dat we nog steeds nodig zijn”, zegt Carlsson. “Het vinden van de juiste balans is lastig.”


